
CRISPRs-Cas9基因編輯的原理
發(fā)布時(shí)間:
2019-08-02
1987年日本研究人員在大腸桿菌基因組中發(fā)現(xiàn)了成簇的規(guī)則間隔回文重復(fù)序列CRISPRs(Clustered Regularly Interspaced Palindromic Repeats,CRISPRs)。2005年發(fā)現(xiàn)CRISPRs中的許多間隔序列與質(zhì)粒和病毒具有同源性,最后證實(shí)CRISPR-Cas是一種自適應(yīng)的防御系統(tǒng),可以使用反義RNA作為過(guò)去被入侵的記憶標(biāo)記,當(dāng)病毒再次入侵時(shí)即可做出快速反應(yīng)。接下來(lái)的研究發(fā)現(xiàn)一共存在三種CRISPR-Cas系統(tǒng)類(lèi)型(I、II和III),它們分別使用不同的分子機(jī)制對(duì)核酸進(jìn)行識(shí)別和剪切。I型和III型系統(tǒng)使用大量復(fù)雜的Cas蛋白作為crRNA介導(dǎo)的DNA剪切,由于其過(guò)于復(fù)雜,具體應(yīng)用難度很大。然而,II型系統(tǒng)只需要一個(gè)單一的蛋白質(zhì)Case9,既可以實(shí)現(xiàn)基因的剪切,簡(jiǎn)單方便,后來(lái)被證明對(duì)基因組工程非常有用,現(xiàn)在被廣泛應(yīng)用于基因編輯和基因治療。
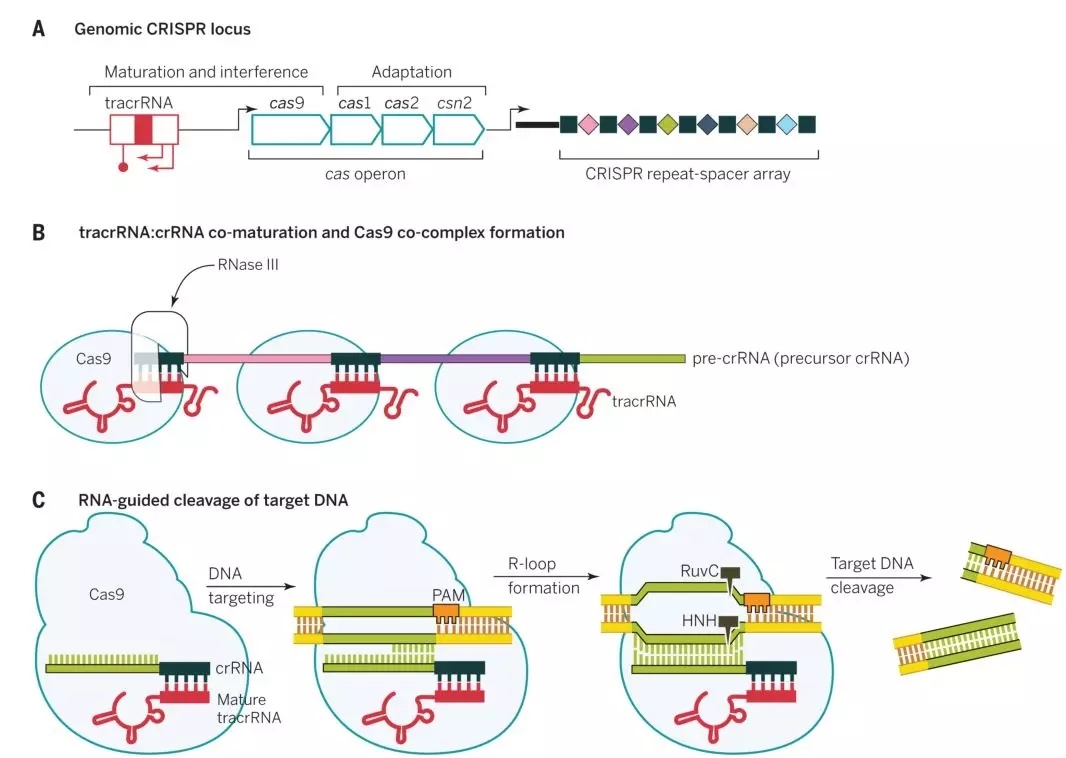
圖1 鏈球菌CRISPRs-Cas9抵抗病毒入侵的機(jī)制
上圖是鏈球菌的CRISPRs-Cas9抗病毒防御機(jī)制,Cas9是一種RNA引導(dǎo)的DNA核酸內(nèi)切酶,其需要在crRNA和tracrRNA雙RNA的指導(dǎo)下對(duì)特定DNA序列進(jìn)行識(shí)別和切割。在CRISPR在基因座里包括tracrRNA、Cas9還有短的重復(fù)序列基因(如圖1a)。它們發(fā)揮作用的具體過(guò)程如下:短的重復(fù)序列基因轉(zhuǎn)錄成pre-crRNA,而tracrRNA對(duì)于pre-crRNA的成熟是必須的,Cas9具有核酸剪切能力。它們首先結(jié)合形成復(fù)合物,在核糖核酸酶Ⅲ作用下進(jìn)一步成熟(如圖1b)。由于crRNA上的20個(gè)堿基能與目標(biāo)DNA的堿基進(jìn)行互補(bǔ)配對(duì),可將復(fù)合物導(dǎo)向目標(biāo)DNA,隨后Cas9對(duì)目標(biāo)基因PAM序列(PAM序列為NGG,N為任意堿基)前的DNA序列進(jìn)行剪切,導(dǎo)致目標(biāo)DNA斷裂形成DSB(DNA double-stranded break,DBS)使入侵的病毒基因組發(fā)生斷裂(如圖1c),導(dǎo)致病毒死亡,進(jìn)而抑制病毒感染。人們利用這種機(jī)制,通過(guò)尋找目的基因特異的PAM序列,將其5‘端前20個(gè)堿基一起合成crRNA,然后將tracrRNA和crRNA改造成單鏈導(dǎo)向的sgRNA(single guide RNA,sgRNA)(圖2)。同時(shí)共轉(zhuǎn)染Cas9,實(shí)現(xiàn)對(duì)目的基因的剪切。
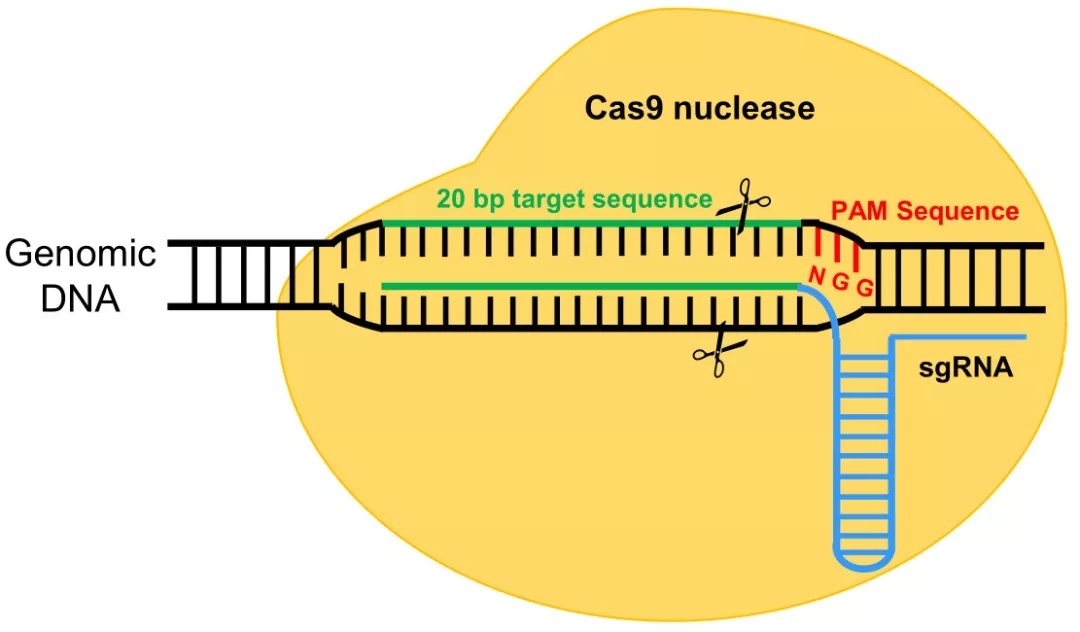
圖2 改造后的CRISPs-Cas9系統(tǒng)
然后利用生物體內(nèi)基因DBS的兩種修復(fù)方式對(duì)目的基因?qū)崿F(xiàn)編輯。具體兩種修復(fù)方式包括非同源重組修復(fù)(NHEJ)和同源重組修復(fù)(HDR)見(jiàn)圖3,NHEJ方式的修復(fù)會(huì)導(dǎo)致目的基因堿基的增加或缺失,導(dǎo)致基因可能發(fā)生移碼突變,達(dá)到基因敲除的目的。而HDR修飾是利用基因同源臂(如等位基因作為模板)可以進(jìn)行同源重組所以可以進(jìn)行精確修復(fù),這樣人們可以通過(guò)外轉(zhuǎn)具有相同同源臂的質(zhì)粒,在同源臂內(nèi)插入基因就可以實(shí)現(xiàn)對(duì)目標(biāo)基因的替換,進(jìn)而實(shí)現(xiàn)基因編輯。
CRISPs-Cas9技術(shù)對(duì)基因編輯具有操作簡(jiǎn)單、成本低、編輯效率較高等優(yōu)點(diǎn),已經(jīng)被廣泛應(yīng)用于疾病、腫瘤等治療,但是目前還存在脫靶效應(yīng)、傳遞效率低、免疫排斥、倫理等問(wèn)題。
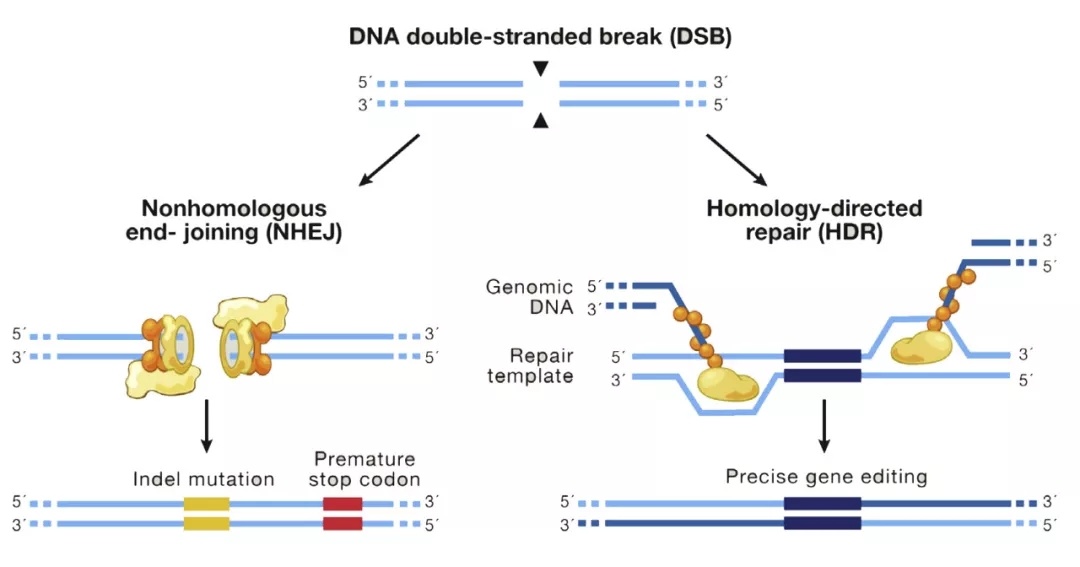
圖3 基因組基因斷裂修復(fù)的兩種方式
主要參考文獻(xiàn):Doudna, Jennifer A., and Emmanuelle Charpentier. "The new frontier of genome engineering with CRISPR-Cas9." Science 346.6213 (2014): 1258096.




